完整交易系统
流畅、安全;遵循实际业务场景
潜在不良全身反应、植入后局部反应、亚急性和亚慢性经口全身毒性、不直接或间接接触患者身体
由
优检联优选
提供服务
商品ID:1374639640215860033
价格
¥148000.0-148000.0
已订购
服务周期: 150天
选择推荐套餐有优惠,或者直接自选检测项目,如有疑问请咨询客服
测试标准/方法:
样品规格:

血液、尿液-《生物检材中苯丙胺类兴奋剂、哌替啶和氯胺酮的测定》-SF/Z JD0107004-2016
哌替啶/甲基苯丙胺/苯丙胺

泥土-微量物证-GB/T 19267.4-2008
微量物质,残留,事实,物理,化学,仪器分析;原子发射光谱法

橡胶-橡胶鉴定-GB/T 7764-2017
《橡胶鉴定红外光谱法》,生胶、硫化胶、未硫化胶、及热塑性弹性体,定性分析

油脂及残留物、火灾现场助燃剂、残留物-微量物证-GB/T 19267.7-2008
气相色谱质谱法,适用于刑事技术领城中微量物证的理化检验

血液、尿液-《生物检材中单乙酰吗啡、吗啡、可待因的测定》-SF/ZJD0107006-2010
血液、尿液、组织及毛发中单乙酰吗啡、吗啡和可待因的免疫筛选法、气相色谱-质谱联用法和液相色谱-串联质谱法
医疗器械生物学评价第11部分:全身毒性试验GB/T 16886.11-2011;

医疗器械生物学评价第6部分:植入后局部反应试验GB/T 16886.6-2015;

医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 14233.2-2005;

医用有机硅材料生物学评价试验方法GB/T 16175-2008;
本标准规定了医用有机硅材料的生物学评价试验方法。
本标准适用于医用有机硅材料的生物学评价。
口腔医疗器械生物学评价第2单元:试验方法亚急性和亚慢性全身毒性试验:经口途径YY/T 0127.15-2018;
本部分规定了口腔医疗器械亚急性和亚慢性经口全身毒性试验方法。
本部分适用于评价与口腔接触的医疗器械经口途径的亚急性和亚慢性全身毒性。
牙科学牙科医疗器械生物相容性评估ISO 7405-2018;
本文件规定了用于牙科的医疗设备生物效应评估的测试方法。它包括药理学药剂的测试,这些药剂是被测设备的一个组成部分。
本文件不包括不直接或间接接触患者身体的材料和设备的检测。
医疗器械生物学评价第11部分:全身毒性试验ISO 10993-11:2017;
规定了在评估医疗器械材料可能引起不良全身反应时应遵循的程序的要求和指导。
医疗器械生物学评价第6部分:植入后局部反应试验ISO 10993-6:2016;
ISO 10993-6:2016规定了用于医疗器械的生物材料植入后局部效应评估的测试方法。
ISO 10993-6:2016适用于以下材料固体和不可吸收的,非固体,如多孔、液体、凝胶、糊状和颗粒状材料,以及可降解和/或可吸收的,可以是固体或非固体。
消毒技术规范(2002年版)
本规范适用于在中华人民共和国境内生产、经营、使用和检验消毒产品的组织,医疗卫生 机构以及传染病疫源地和其他一切需要消毒的场所。
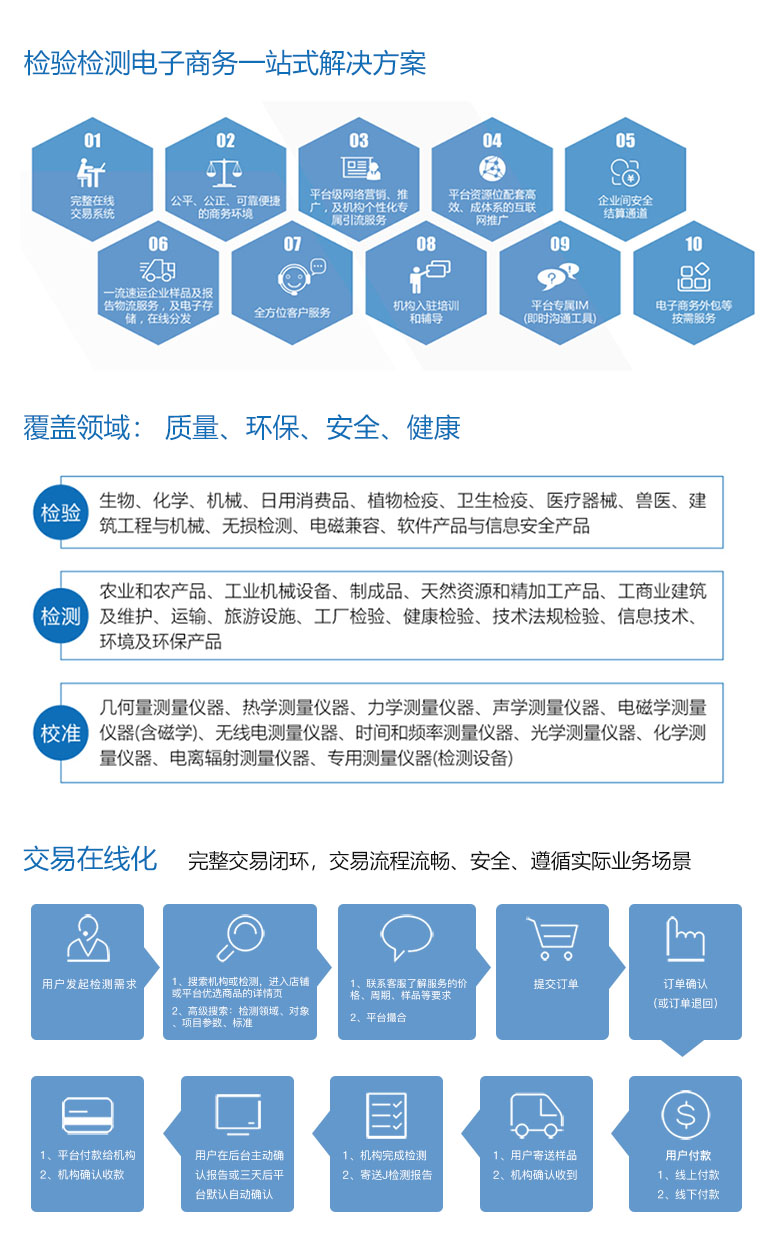

完整交易系统
流畅、安全;遵循实际业务场景
安全便捷支付
支持线上线下多种支付方式
专业资质审核
安全可信赖检测机构
数据查询追踪
全程服务全程跟进